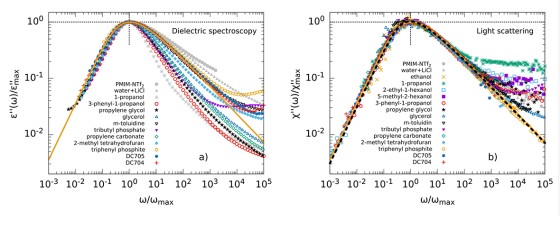
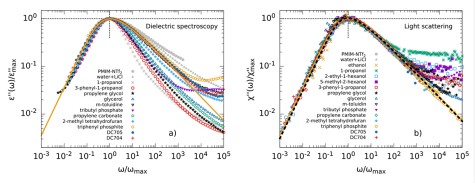
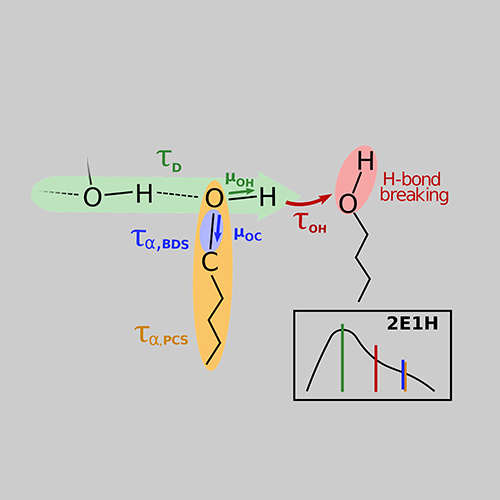
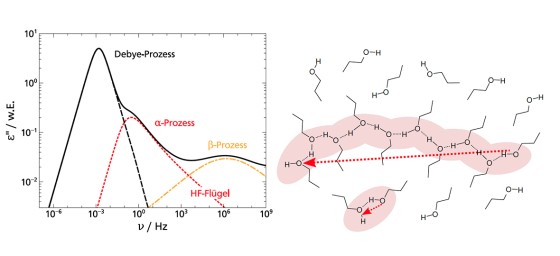
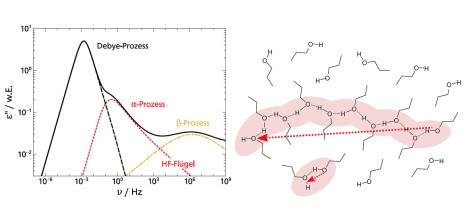
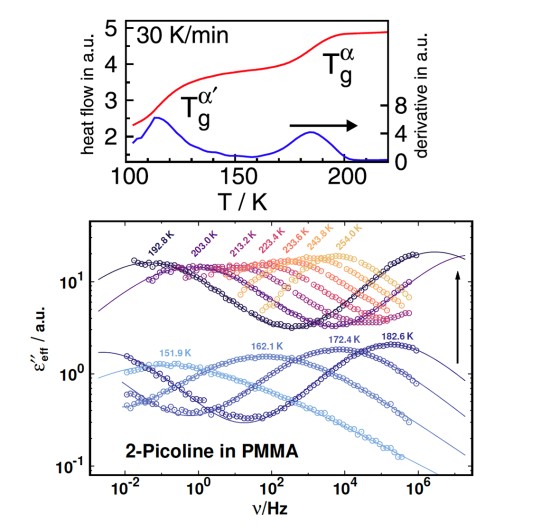
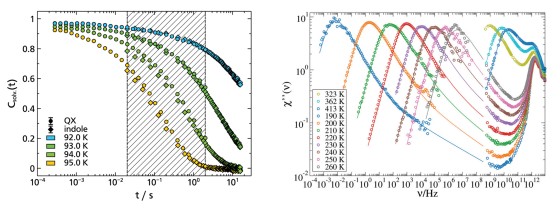
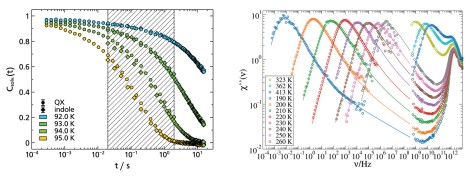
Der dielektrische Verlust ϵ′′ bei Experimenten der Breitbandigen Dielektrischen Spektroskopie (BDS) bzw. der Imaginärteil der generalisierten Suszeptibilität χ′′ bei Experimenten der Depolarisierten Dynamischen Lichstreuung (DDLS) enthält mehrere Peaks, die verschiedenen Prozessen der molekularen Dynamik zuzuordnen sind. Die spektrale Form des sogenannten α-Prozesses ist dabei von besonderem Interesse, da dieser mit der makroskopischen Viskosität verknüpft ist.
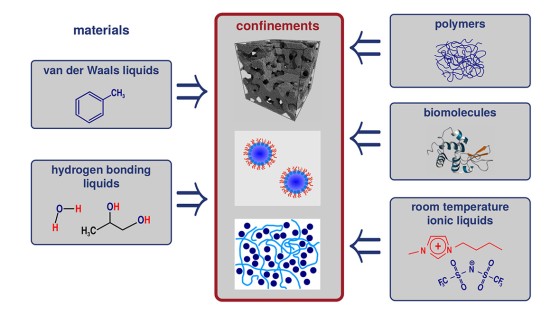
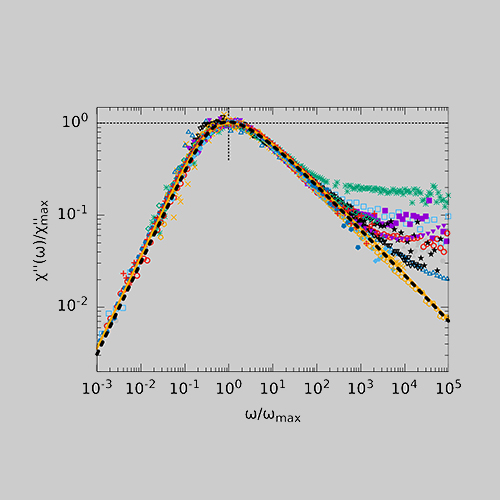
Beim Vergleich verschiedener glasbildender Flüssigkeiten in der BDS zeigt der α-Prozess stark abweichende Formparameter βKWW der korrespondierenden Korrelationsfunktion, welche typischerweise zwischen 0,5 und 0,8 liegen. In der DDLS ergibt sich ein anderes Bild. Hier zeigt eine große Anzahl von Flüssigkeiten die gleiche, „generische“ spektrale Form, welche bei hohen Frequenzen durch ein Potenzgesetz ∝ ω−1/2 beschrieben werden kann. Die Abbildung zeigt Daten verschiedener glasbildender Flüssigkeiten gemessen durch BDS (links) und DDLS (rechts). Die gezeigten Substanzen enthalten sehr unterschiedlich polare Flüssigkeiten, Van-der-Waals-Flüssigkeiten, wasserstoffbrückenbildende Systeme und einige ionische Flüssigkeiten.